Électrolyse de l'eau
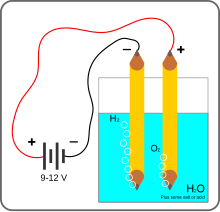
L'électrolyse de l'eau est un procédé électrolytique qui décompose l'eau (H2O) en dioxygène et dihydrogène gazeux grâce à un courant électrique. La cellule électrolytique est constituée de deux électrodes — habituellement en métal inerte dans la zone de potentiel et de pH considérée, typiquement du groupe du platine — immergées dans un électrolyte (ici l'eau elle-même) et connectées aux pôles opposés de la source de courant continu.

Historique[modifier | modifier le code]
La première électrolyse de l'eau a été réalisée le par deux chimistes britanniques, William Nicholson (1753-1815) et Sir Anthony Carlisle (1768-1840), quelques semaines après l'invention de la première pile électrique (publication soumise le ) par Alessandro Volta.
Onze ans auparavant J.R. Deiman et A. Paets van Troostwijk avaient déjà réalisé une électrolyse de l'eau au moyen d'une machine électrostatique et d'une bouteille de Leyde sans réussir à interpréter la réaction observée.
Principe et description du processus[modifier | modifier le code]
Le courant électrique dissocie la molécule d'eau H2O en ions hydroxyde HO− et hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la cathode dans une réaction d'oxydoréduction en formant du dihydrogène gazeux H2, selon la réaction de réduction :
alors qu'une oxydation des ions hydroxyde — qui perdent donc des électrons — se produit à l'anode afin de « fermer » le circuit électrique (équilibre de la réaction chimique en charges) :
ce qui donne l'équation de décomposition par électrolyse suivante :
- 2 H2O liq ⟶ 2 H2 gaz + O2 gaz.
La quantité de dihydrogène gazeux produite est donc équivalente à deux fois la quantité de dioxygène, en nombre de molécules. Selon la loi d'Avogadro, le volume récupéré de dihydrogène produit est aussi deux fois plus important que celui de dioxygène.
En ce qui concerne la masse, les ratios sont les suivants:
- H2O liq : 18,015 3 ± 0,000 4 g/mol ;
- H2 gaz : 2,015 88 ± 0,000 14 g/mol ;
- O2 gaz : 31,998 8 ± 0,000 6 g/mol.
Ainsi, pour produire une tonne d'hydrogène, 8936,7 ± 0,8 kilogrammes d'eau sont nécessaires.
Spontanéité du processus[modifier | modifier le code]

La décomposition de l'eau en dihydrogène et dioxygène dans les conditions normales de température et de pression n'est pas favorisée thermodynamiquement, les potentiels standard des deux demi-réactions étant négatifs.
- Anode (oxydation) : 2 H2O liq ⟶ O2 gaz + 4 H+aq + 4 e− E0 = 1,23 V.
- Cathode (réduction) : 4 H+aq + 4 e− ⟶ 2 H2 gaz E0 = 0 V.
- 2 H2O liq ⟶ 2 H2 gaz + O2 gaz :
*(valeurs de S° : H2 gaz = 131,0 ; O2 gaz = 205,0 ; H2O liq = 69,9 ; H2O gaz = 188,7 J K−1 mol−1)
D'autre part, l'énergie libre de Gibbs pour le processus dans des conditions standard est ΔG°= −n F E° (où E° est le potentiel de cellule, soit Eocell = Eocathode − Eoanode = −1,229 4 V, et F est la constante de Faraday, soit 96 485,332 123 3 C/mol, et ici n = 4) est à valeur largement positive (environ 474,48 kJ/2 mol(H2O) = 237,24 kJ/mol(H2O)).
Ces considérations rendent dans un environnement normal la réaction « impossible » à effectuer sans ajouter des électrolytes en solution. Mais les rayonnements ionisants sont capables de provoquer cette réaction sans apport d'élément chimique externe, on parlera alors de radiolyse.
Choix de l'électrolyte[modifier | modifier le code]
L'eau pure conduit peu l'électricité, ce qui conduit à l'emploi d'un additif hydrosoluble — électrolyte — dans la cellule d'électrolyse pour « fermer » le circuit électrique (autrement dit, faire en sorte que les potentiels chimiques en jeu permettent la réaction chimique). L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels.
Une attention particulière doit être portée au choix de l'électrolyte. En effet, l'anion apporté est en compétition directe avec les ions hydroxyde pour la perte d'électron. Un électrolyte anionique avec un potentiel standard d'électrode inférieur à celui de l'hydroxyde sera oxydé à sa place, ne produisant donc pas de dioxygène. De manière similaire, un cation avec un potentiel standard d'électrode supérieur à celui de l'ion hydrogène sera réduit à sa place, donc il n'y aura pas de production de dihydrogène.
Les cations suivants ont des potentiels d'électrode inférieurs à celui de H+ et sont par conséquent acceptables pour un usage en tant que cations d'électrolyte : Li+, Rb+, K+, Cs+, Ba2+, Sr2+, Ca2+, Na+ et Mg2+, soit des alcalins ou alcalino-terreux. Le sodium et le potassium, qui forment des sels solubles et peu chers, sont les plus fréquemment utilisés : on utilise par exemple la potasse avec des électrodes en nickel dans les électrolyseurs industriels.
Si un acide est utilisé comme électrolyte, le cation libéré est H+ et il n'existe alors pas de compétition avec H+ libéré par la dissociation de l'eau. Dans ce cas de figure, l'anion le plus communément utilisé est le sulfate SO42− (l'acide ajouté est l'acide sulfurique H2SO4), très difficile à oxyder. Le potentiel standard d'oxydation de cet ion en ion peroxodisulfate S2O82− est de 2,05 V. À l'anode :
D'autres acides forts sont fréquemment utilisés comme électrolytes.
Techniques[modifier | modifier le code]
Cette expérience est simple à répéter. Deux électrodes reliées aux pôles d'une pile et plongées dans un verre d'eau additionnée d'un peu d'électrolyte est suffisant pour produire un « courant » visible de bulles de dihydrogène ou de dioxygène à chaque électrode. La présence d'ions hydroxyde peut être détectée par un indicateur de pH comme la phénolphtaléine ou le bleu de bromothymol.

Voltamètre d'Hoffmann[modifier | modifier le code]
Le voltamètre d'Hoffmann est parfois utilisé comme cellule électrolytique de taille réduite. Il consiste en trois tubes joints par la base. Le cylindre médian est ouvert en haut pour permettre l'addition d'eau et d'électrolyte. Une électrode de platine est placée à l'intérieur de chacun des tubes latéraux, plus précisément à leur base, et connectée à un des deux pôles d'une source d'électricité. Lorsque le courant passe au travers du voltamètre d'Hofmann, du dioxygène gazeux se forme à l'anode et du dihydrogène à la cathode. Chaque gaz déplace l'eau et peut être collecté à l'extrémité des deux tubes latéraux.
Électrolyse industrielle[modifier | modifier le code]
De nombreuses cellules électrolytiques industrielles sont tout à fait similaires au voltamètre d'Hoffmann, munies d'électrodes en nid d'abeilles recouvertes d'une fine pellicule de catalyseurs variés, parfois de la famille du platine, mais aussi de cobalt et autres matériaux plus économiques[1]. Le dihydrogène est habituellement produit, collecté et brûlé sur place, son énergie volumique étant trop faible pour qu'il soit stocké ou transporté de manière économiquement rentable[réf. nécessaire]. Le dioxygène gazeux est traité comme un sous-produit.
En 2021, trois filières industrielles de production d'hydrogène coexistent[2] :
- les électrolyseurs alcalins, vieux de plus de 100 ans, de plusieurs mégawatts de puissance et pouvant produire plus de 1 000 Nm3 d'hydrogène par heure. Ils utilisent la potasse comme électrolyte et des électrodes en nickel. Les rendements énergétiques de tels électrolyseurs sont de l’ordre de 75 à 90 %, pour une durée de vie supérieure à 80 000 heures de fonctionnement, pouvant atteindre 160 000 heures (soit environ 18 ans)[3]. Il faut une consommation d'environ 5 kWh pour produire 1 m3 d'hydrogène ;
- les électrolyseurs à électrolytes acides PEM (« proton exchange membrane ») sont caractérisés par un électrolyte solide à membrane polymère conductrice de protons. Ils présentent comme avantages, par rapport aux précédents, l'absence d’électrolyte liquide, la compacité, la simplicité de leur conception et de leur fonctionnement, la limitation des problèmes de corrosion, des performances sensiblement supérieures et une moindre influence de la variation des conditions d’entrée (qui sont le cas des sources renouvelables intermittentes). Ils sont en revanche plus chers, car ils requièrent des électrodes aux métaux nobles (du platine en général)[4]. Cette technique est par exemple présente sur les sous-marins nucléaires pour produire l'oxygène, l'hydrogène étant évacué discrètement ;
- les électrolyseurs à haute température, assez récents.
On commence à optimiser les réactions électrochimiques en imitant certains processus biologiques (végétaux notamment). En 2012, les résultats de premiers essais de catalyseurs bio-inspirés, imitant le fonctionnement d'enzymes naturels, montrent que du cobalt pourrait remplacer le coûteux platine pour la production d'hydrogène et/ou la production d'oxygène par électrolyse de l'eau[5],[6],[7]. Deux composés sont proposés (en 2012), le premier utilisable en solutions aqueuses de pH neutre sous forme de « nanoparticules de cobalt enrobées d'un oxo-phosphate de cobalt », et l'autre étant « le premier matériau catalytique « commutable » et sans métaux nobles jamais créé capable d'intervenir dans les deux réactions chimiques essentielles à l'électrolyse de l'eau : la production d'hydrogène et la production d'oxygène »[7] (des catalyseurs bio-inspirés, à base de nickel sur nanotubes de carbone étaient déjà proposés, mais efficaces uniquement en milieu fortement acide). Ce nanocatalyseur est commutable, ceci signifie qu'il « peut se transformer de manière réversible d'une forme chimique à une autre, chacune correspondant à une activité catalytique spécifique ». Reste à tester l'industrialisation du processus.
Réalisations[modifier | modifier le code]
En France[modifier | modifier le code]
En , quatre projets d'usines d'électrolyseurs (dites « gigafactories ») sont en gestation en France : la startup française McPhy annonce en mai avoir choisi Belfort pour construire son site industriel ; John Cockerill, entreprise belge à capitaux français, dépose en juin des demandes de permis pour s'implanter à Aspach, dans le Haut-Rhin ; Genvia, coentreprise du parapétrolier américain Schlumberger et du CEA, prépare une implantation à Béziers, dans l'Hérault ; Elogen, filiale de la société d'ingénierie GTT, envisage aussi une usine à Vendôme. Les technologies retenues sont diverses : alcalin, membrane à échange de protons, haute température. McPhy vise un démarrage début 2024 et John Cockerill début 2023. Genvia, qui développe une technologie haute température moins mature, n'annoncera sa décision d'investissement définitive que « fin 2023, début 2024 »[8].
Électrolyse à haute température[modifier | modifier le code]
L'électrolyse à haute température (ou HTE, en anglais : high-temperature electrolysis, ou « électrolyse en phase vapeur ») est une méthode étudiée pour l'électrolyse de l'eau par machine thermique. L'électrolyse à haute température est plus efficace que le procédé à température ambiante puisqu'une partie de l'énergie nécessaire à la réaction est apportée via la chaleur, moins chère à obtenir que l'électricité, et que les réactions d'électrolyse ont un meilleur rendement à haute température[réf. souhaitée].
L’électrolyse à haute température s’effectue dans une gamme de températures qui varient entre 700 °C et 1 000 °C. La tension d’une cellule varie entre 0,8 et 0,9 V à courant nul, au lieu d’environ 1,25 V (à 70 °C) pour l’électrolyse alcaline. Au niveau du cœur de l’électrolyseur, l’énergie nécessaire à la production d’1 Nm3 d’hydrogène est comprise entre 3 et 3,5 kWh ; le rendement énergétique est compris entre 80 et 90 %[3].
Applications[modifier | modifier le code]
Production de dihydrogène[modifier | modifier le code]
Environ 0,04 % du dihydrogène gazeux produit dans le monde en 2021 l'est par électrolyse[9] et habituellement utilisé sur place. Le dihydrogène est utilisé pour la synthèse d'ammoniac comme engrais, par le procédé Haber-Bosch, et pour la conversion du pétrole lourd en fractions plus légères, par hydrocraquage.
Le vaporeformage du méthane fournit, en 2015, 49 % du dihydrogène produit dans le monde, qualifié d'hydrogène gris parce que la production s'accompagne alors de rejets de dioxyde de carbone.
L'utilisation du dihydrogène comme vecteur énergétique, dans la perspective d'une économie hydrogène, ne parvient pas à se développer notablement dans les années 2010 : les véhicules à hydrogène, encore très chers (cinq à dix fois plus chers qu'une voiture thermique comparable), ne rencontrent pas de succès commercial. Fin 2018, leurs ventes atteignent 11 200 voitures dans le monde, limitées à des achats gouvernementaux selon l'Agence internationale de l'énergie[réf. nécessaire], dont plus de 9 000 Toyota Mirai.
Alternative à l'acétylène pour la soudure[modifier | modifier le code]
Des postes à souder utilisant les produits de l'électrolyse de l'eau existent depuis 2013. Les soudeurs peuvent ainsi se passer de bouteilles d'acétylène, remplacé par de l'eau déminéralisée et un poste consommant 2 kW de puissance électrique[10].
Efficacité et rendement[modifier | modifier le code]
Le rendement énergétique de l'électrolyse de l'eau peut varier de manière importante. La gamme de rendement varie de 50-70 %[11] à 80-92 %[12] selon les sources. The Shift Project retient ainsi la fourchette de 60-75 %[13]. Ces valeurs se réfèrent seulement au rendement de la conversion de l'énergie électrique en énergie chimique de l'hydrogène ; l'énergie perdue lors de la génération de l'électricité n'est pas comptabilisée.
Cadre juridique[modifier | modifier le code]
La « Directive européenne sur les émissions industrielles » (IED)[14] encadre le fonctionnement des 50 000 installations les plus polluantes de l'Union européenne[15]. L'IED établit des « règles relatives à la prévention et à la réduction intégrées de la pollution résultant des activités industrielles [...] afin de prévenir ou, lorsque cela n'est pas réalisable, de réduire les émissions dans l'air, l'eau et le sol et d'éviter la production de déchets, afin d'atteindre un niveau élevé de protection de l'environnement pris dans son ensemble ». Elle inclut dans son périmètre la production d'hydrogène à échelle industrielle[16]. En effet, même si les émissions de polluants et l'impact environnemental global provenant de la production d'« hydrogène vert » peuvent être inférieurs à ceux associés à la production d'hydrogène à partir d'hydrocarbures, ils peuvent s'accompagner d'autres incidences sur l'environnement, telles que des risques d'accidents. Par ailleurs, en facilitant la participation de la société civile aux décisions d'autorisation des installations, l'IED permet des niveaux plus élevés d'acceptation par le public et réduit les risques d'investissement pour les exploitants.
L'Institut allemand pour la protection du climat, l’énergie et la mobilité (IKEM) plaide pour un autre cadre juridique, excluant les petits électrolyseurs, produisant de l'hydrogène en quantité industrielle[17], du champ d’application de cette directive et appliquant une procédure d’approbation simplifiée pour les installations de capacité moyenne[18].
Références[modifier | modifier le code]
- (en) « Catalytic Coating », sur De Nora (consulté le ).
- Production d’hydrogène par électrolyse de l'eau, Afhypac (no Fiche 3.2.1), , 15 p. (lire en ligne [PDF]).
- « Les différentes technologies d’électrolyseurs », sur hqe.guidenr.fr, GuidEnR HQE (consulté le ).
- « Production d’hydrogène par électrolyse de l'eau » [PDF], sur afhypac.org, (consulté le ).
- (en) E. S. Andreiadis, P.-A. Jacques, P. D. Tran, A. Leyris, M. Chavarot-Kerlidou, B. Jousselme, M. Matheron, J. Pécaut, S. Palacin, M. Fontecave, V. Artero, « Molecular Engineering of a Cobalt-based Electrocatalytic Nano-Material for H2 Evolution under Fully Aqueous Conditions », Nature Chemistry, 2012, DOI 10.1038/NCHEM.1481.
- S. Cobo, J. Heidkamp, P.-A. Jacques, J. Fize, V. Fourmond, L. Guetaz, B. Jousselme, R. Salazar, V. Ivanova, H. Dau, S. Palacin, M. Fontecave, V. Artero, « A Janus cobalt-based catalytic material for electro-splitting of water », Nature Materials, no 11, 2012, p. 802, DOI 10.1038/nmat3385.
- Production d'hydrogène : si le cobalt remplaçait le platine, université Joseph-Fourier, 31 octobre 2012.
- Hydrogène : la filière industrielle française est en train d'émerger, Les Échos, 11 juin 2021.
- Un « élan croissant » pour la production d'hydrogène bas carbone mais..., Connaissance des énergies, 22 septembre 2022.
- Grégoire Noble, « Fini l'acétylène, maintenant on soude à l'eau », sur Batiactu, (consulté le ).
- (en) « Hydrogen and Fuel Cell News », sur hyweb.de.
- (en) Bjørnar Kruse, Sondre Grinna et Cato Buch, Hydrogen : Status og muligheter (Bellona rapport no 6), Bellona, , 53 p. (lire en ligne [PDF]).
- « Document de travail - Énergie » [PDF], sur The Shift Project, , p. 24.
- La directive IED est la fusion de la directive 2008/1/CE relative à la prévention et à la réduction intégrées de la pollution, dite « directive IPPC », et de six autres directives sectorielles : la directive relative aux grandes installations de combustion (2001/80/CE), la directive sur l’incinération de déchets (2000/76/CE), la directive relative aux émissions de solvants (1999/13/CE) et trois directives relatives à l’industrie du dioxyde de titane (78/176/CEE, 82/883/CEE, 92/112/CEE).
- « Bruxelles dévoile son projet de révision de la directive sur les émissions industrielles », sur actu-environnement.com, 6 avril 2022.
- Voir son Annexe I point 4.2(a).
- « Directive 2010/75/UE du Parlement européen et du Conseil du 24 novembre 2010 relative aux émissions industrielles (prévention et réduction intégrées de la pollution) », sur EUR-Lex, voir annexe I, point 4 : la Directive IED couvre uniquement la production d’hydrogène en quantité industrielle.
- « Les Électrolyseurs visés par une Directive Européenne », sur Energynews.pro, (consulté le ).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
- Craquage de l'eau
- Électrochimie
- Électrolyse
- Production d'hydrogène
- Craquage de gaz
- Détecteur électrolytique
Sources[modifier | modifier le code]
- « Électrolyse de l'eau », Experiments on Electrochemistry (consulté le )
- « Électrolyse de l'eau », Do Chem 044 (consulté le )

